








《《化学反应热的计算》高二化学选修四复习总结PPT课件》是由用户上传到老师板报网,本为文库资料,大小为541 KB,总共有29页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 29页
- 541 KB
- VIP模板
- ppt
- 数字产品不支持退货
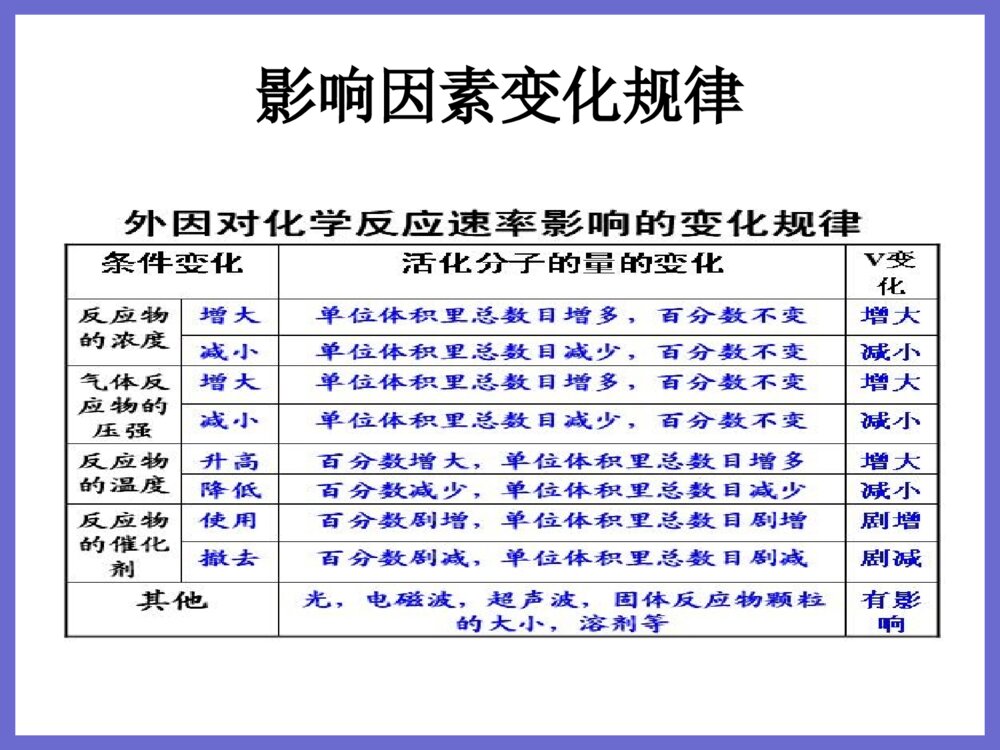
第一章化学反应与能量第一节化学反应与能量变化一、焓变、反应热化学键与化学反应中的能量变化的关系、△H的计算式常见的吸热反应、放热反应及其对应图像二、热化学方程式的书写(结合燃烧热、中和热)燃烧热:常见物质有乙醇、甲烷、丙烷、乙烯中和热:H+(aq)+OH-(aq)=H2O(l)H=-57.3kJ/mol△△H大小的比较三、中和热的测定环形玻璃搅拌棒、实验大概步骤、操作注意之处及原因第二节燃烧热一、燃烧热.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。※注意以下几点:①研究条件:101kPa②反应程度:完全燃烧,产物是稳定的氧化物。③燃烧物的物质的量:1mol④研究内容:放出的热量。(ΔH<0,单位kJ/mol)二、中和热1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。第三节化学反应热的计算一、盖斯定律(主要是应用)1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。2、运用:根据盖斯定律,可以设计反应求出另一个反应的反应热。二、反应热的计算 反应热的计算类型:A.根据反应热的概念的计算B根据热化学方程式的计算C根据化学键键能的计算D利用盖斯定律的计算第二章化学反应速率和化学平衡第一节化学反应速率一、化学反应速率化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件影响因素变化规律注意•※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。•(2)、惰性气体对于速率的影响•①恒温恒容时:充入惰性气体→总压增大,但是各分压不变,各物质浓度不变→反应速率不变•②恒温恒体时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢第二节影响化学反应速率的因素一、有效碰撞理论活化分子;活化能;活化分子百分数;有效碰撞二、外界条件对反应速率的影响1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡_不移动_(3)在溶液中进行的反应,如果稀释溶液,反应物浓度__减小__,生成物浓度也_减小_,V正_减小__,V逆也_减小__,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。外界条件对反应速率的影响•2、温度对化学平衡移动的影响•影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。•3、压强对化学平衡移动的影响•影响规律:其他条件不变时,增大压强,会使平衡向着体积缩小方向移动;减小压强,会使平衡向着体积增大方向移动。•注意:(1)改变压强不能使无气态物质存在的化学平衡发生移动•(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似外界条件对反应速率的影响•4、催化剂对化学平衡的影响:由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。但是使用催化剂可以影响可逆反应达到平衡所需的时间。•5、勒夏特列原理(平衡移动原理):如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。第三节化学平衡一、化学平衡状态的建立定义、特征 (5个)、化学平衡状态标志的判断(变量不变)影响化学平衡状态的因素(浓度、温度、压强)及平衡的移动催化剂不能使平衡发生移动、勒夏特列原理等效平衡全等(任何化学平衡)相似恒T恒P(无需看分子数):相似或全等恒T恒V(看分子数)分子数不变:相似/全等分子数改变:全等化学平衡图像速率——时间(判断改变条件、平衡移动)转化率——温度——压强(定一变二)转化率——T/P——时间(先拐先平数值大)二、化学平衡常数表达式、K值只与温度有关、转化率的计算计算题(列出起始、转化、平衡浓度)第四节化学反应进行的方向金属腐蚀快慢的规律:在同一电解质溶液中,金属腐蚀的快慢规律如下:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀防腐措施由好到坏的顺序如下:外接电源的阴极保护法>牺牲负极的正极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀反应方向判断依据•在温度、压强一定的条件下,化学反应的判读依据为:•ΔH-TΔS〈0反应能自发进行•ΔH-TΔS=0反应达到平衡状态•ΔH-TΔS〉0反应不能自发进行•注意:(1)ΔH为负,ΔS为正时,任何温度反应都能自发进行•(2)ΔH为正,ΔS为负时,任何温度反应都不能自发进行第三章水溶液中的离子平衡第一节弱电解质的电离一、强弱电解质常见的强弱电解质的类型并学会判断与导电性、溶解性无关二、弱电解质的电离平衡电离方程式的书写(强等号、弱可逆、多元弱酸分步写、多元弱碱一步完、NaHSO4、NaHCO3)影响电离平衡的因素(浓度、温度、稀释、同离子效应、化学反应)第二节水的电离与溶液酸碱性一、水的电离水的离子积(常温1.0×10-14)、只与温度有关影响水电离的因素(温度、加酸/碱、加会水解的盐)二、溶液的酸碱性与pH酸碱性本质(H+、OH-浓度相对大小)、pH=-lgc(H+)pH的计算(稀释、两强的混合、酸碱混合)酸碱中和滴定(仪器、操作步骤、终点现象、误差分析、实验结果数据处理)第三节盐类水解一、盐类水解强酸强碱盐、强酸弱碱盐、强碱弱酸盐的酸碱性原因、实质、规律、水解的离子方程式的书写影响水解平衡的因素(温度、浓度、稀释、加酸/碱、双水解)二、盐类水解的应用pH大小的比较、离子共存、同种离子不同溶液的浓度比较离子浓度大小顺序(同一溶液中、两种溶液的混合)三大守恒(电荷守恒、物料守恒、质子守恒)第四节难溶电解质的溶解平衡1、难溶电解质的溶解平衡的一些常见知识(1)溶解度小于0.01g的电解质称难溶电解质。(2)反应后离子浓度降至1*10-5以下的反应为完全反应。如酸碱中和时[H+]降至10-7mol/L<10-5mol/L,故为完全反应,用“=”,常见的难溶物在水中的离子浓度均远低于10-5mol/L,故均用“=”。(3)难溶并非不溶,任何难溶物在水中均存在溶解平衡。(4)掌握三种微溶物质:CaSO4、Ca(OH)2、Ag2SO4(5)溶解平衡常为吸热,但Ca(OH)2为放热,升温其溶解度减少。(6)溶解平衡存在的前提是:必须存在沉淀,否则不存在平衡。第四章电化学基础第一节原电池定义、电极及发生的反应、盐桥的作用正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极(4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极(5)根据实验现象①__溶解的一极为负极__②增重或有气泡一极为正极第二节化学电源了解常见的一次电池、二次电池碱性锌锰电池、铅蓄电池2、电极反应:铅蓄电池放电:负极(铅):Pb+-2e=PbSO4↓正极(氧化铅):PbO2+4H+++2e=PbSO4↓+2H2O充电:阴极:PbSO4+2H2O-2e=PbO2+4H++放电充电阳极:PbSO4+2e=Pb+两式可以写成一个可逆反应:PbO2+Pb+2H2SO42PbSO4↓+2H2O第三节电解池1、电解池:把电能转化为化学能的装置也叫电解槽2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程4、电子流向:(电源)负极—(电解池)阴极—(离子定向运动)电解质溶液—(电解池)阳极—(电源)正极5、电极名称及反应:阳极:与直流电源的正极相连的电极,发生氧化反应阴极:与直流电源的负极相连的电极,发生还原反应6、电解CuCl2溶液的电极反应:阳极:2Cl--2e=Cl2(氧化)阴极:Cu2++2e=Cu(还原)总反应式:CuCl2=Cu+Cl2↑第四节金属腐蚀及防护一、电化学腐蚀吸氧腐蚀及析氢腐蚀的条件、电极反应式、现象解释两者的比较二、电化学防护牺牲阳极保护法、外加电流的阴极保护法其他的应用及解释化学腐蚀与电化腐蚀的比较•电化腐蚀化学腐蚀条件不纯金属或合金与电解质溶液接触金属与非电解质直接接触现象有微弱的电流产生无电流产生本质较活泼的金属被氧化的过程金属被氧化的过程关系化学腐蚀与电化腐蚀往往同时发生,但电化腐蚀更加普遍,危害更严重电化学腐蚀的分类:•析氢腐蚀——腐蚀过程中不断有氢气放出•①条件:潮湿空气中形成的水膜,酸性较强(水膜中溶解有CO2、SO2、H2S等气体)•②电极反应:负极:Fe–2e-=Fe2+•正极:2H++2e-=H2↑•总式:Fe+2H+=Fe2++H2↑•吸氧腐蚀——反应过程吸收氧气•①条件:中性或弱酸性溶液•②电极反应:负极:2Fe–4e-=2Fe2+•正极:O2+4e-+2H2O=4OH-•总式:2Fe+O2+2H2O=2Fe(OH)2•离子方程式:Fe2++2OH-=Fe(OH)2•生成的Fe(OH)2被空气中的O2氧化,生成Fe(OH)3,Fe(OH)2+O2+2H2O==4Fe(OH)3•Fe(OH)3脱去一部分水就生成Fe2O3·xH2O(铁锈主要成分)规律总结•金属腐蚀快慢的规律:在同一电解质溶液中,金属腐蚀的快慢规律如下:•电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀•防腐措施由好到坏的顺序如下:•外接电源的阴极保护法>牺牲负极的正极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀谢谢大家!



















